Evolução dos Modelos Atómicos

A Evolução do Modelo Atômico Contou com a Contribuição de Quatro Cientistas principais: Dalton, Thomson, Rutherford e Bohr
Um grande Passo rumo ao Desenvolvimento da Química Ciência Como foi a Evolução do Entendimento uma atômica Respeito da Estrutura. Por Exemplo, foi Possível entendre O Que constitui Uma Matéria, Prever determinados comportamentos dos materiais, entendre e Manipular a radioatividade, Produzir Produtos de NOSSOS Interesses e ASSIM POR Diante.
Mas, Para Que chegássemos ATE UM ideia Atual da Estrutura atômica, foi Preciso O Pensamento de filosofos, hipóteses Que levantaram, é isto, suposições que na Época NÃO podiam Ser comprovadas, Sobre a Constituição da Matéria. Entre ELES estavam Os Dois filosofos Gregos Demócrito e Leucipo Que, em meados de 450 aC, levantaram a hipótese de Que Tudo Séria Formado POR Pequenas particulas indivisíveis, que eles denominaram de Átomos. Essa Palavra VEM fazer Grego hum , Que significa "não", e tomo , "parte", OU SEJA, "sem partes" ou "indivisível". ISSO Significa Que se fossemos dividindo sucessivamente hum Corpo, chegaríamos num momento em Que ISSO NÃO Séria Mais Possível, chegaríamos porqué um menor Parte Que compõe a Matéria.
No entanto, o SUAS ideias Não foram aceitas Bem Pelos filosofos da Época e Elas foram substituídas POR Otras, Como Como ideias de Aristóteles que perduraram POR Séculos à frente.
FOI SOMENTE no Século XIX que Uma ideia dos Átomos foi Retomada, POIs ágora OS Cientistas podiam Testar Como SUAS hipóteses POR Meio de Experimentos de Pará Comprova-los UO de Pará refutar Ideias Cientistas de Outros. Logo Mais Abaixo, TEMOS Alguns dos principais Cientistas Que contribuíram Para O Estudo da Constituição do átomo, que São Vistos no Ensino Médio.
Embora algumas ideias NÃO estivessem Totalmente corretas, Todas As contribuições Dadas foram IMPORTANTES, POIs foi a Partir da ideia de hum Cientista Que O Outro PODE desenvolver o Próximo Modelo.
Todos Enguias elaboram hum Modelo Atômico , OU SEJA, Uma Representação Que NÃO corresponde exatamente à Realidade, Mas que servem Pará explicar corretamente o Comportamento do átomo. Por Exemplo, imagine que Rápido rápido Você FAÇA UM Desenho identico Uma caneta UMA. Por Meio Deste desenho, Todos conseguem identificar Que se Trata de Uma caneta, porem o Desenho Não É Uma caneta. De Modo Semelhante, o Modelo Atômico SERVIR Pará entendermos o FUNCIONAMENTO fazer ATOMO, o SUAS PROPRIEDADES e Funcionalidades. Mas, o Modelo Não É exatamente igual Ao átomo.
Vejamos ENTÃO OS principais modelos Atómicos:
1- Modelo de Dalton:
O químico Inglês John Dalton (1766-1844) retomou Como ideias de Leucipo e Demócrito e, baseando-se em colares Já comprovadas experimentalmente, Como Como Leis Ponderais , ELE Propos resumidamente Que o átomo Seria parecido com Uma bola de bilhar , é isto, esférico, maciço e indivisível.

2 Modelo de Thomson:
A era Natureza Elétrica da Matéria Já conhecida Bem, Por Exemplo, há 2500 anos, na Grécia Antiga, O filosofo Tales de Mileto havia ja mostrado que quando atritamos âmbar com hum Pedaço de lã, ELE Passa a atrair leves Objetos. Porem, o Modelo Atômico de Dalton NÃO explicava Esse Fato: como a Matéria neutra podios Ficar Elétrica.
ASSIM, em 1897, o Físico Inglês Joseph John Thomson (1856-1940) Passou a trabalhar Há A Há com Uma ampola de Crookes, OU SEJA, UM gases Tubo Onde ERAM submetidos a voltagens elevadíssimas, catódicos produzindo Raios. QUANDO se colocava hum campo elétrico externo, sos Raios se desviavam em Direção à placa positiva, O Que Que significava o átomo Terios particulas negativas, que ficaram denominadas elétrons Como.
No entanto, Como um neutra Natureza da Matéria E, Uma explicação razoavel Seria De que haveria Uma PARTE positiva que elétrons neutralizaria OS. Com base de de raciocínio Nesse, em 1903, Thomson modificou o Modelo de Dalton, POIs o átomo NÃO Séria maciço NEM indivisível, e estabeleceu o Seu, que propos o SEGUINTE:
O átomo E UMA esfera de carga positiva Elétrica, Não maciça, incrustada de elétrons (particulas negativas), de MoDo Que SUA carga nula totais de SEJA.

3- Modelo de Rutherford:
Em 1911, o Físico neozelandês Ernest Rutherford (1871-1937) realizou hum experimento Que PODE Ser visto Nenhum texto Átomo de Rutherford , em Que ELE bombardeou Uma finíssima Lâmina de Ouro com particulas alfa vindas Fazer radioativo Polônio. Ele observou que das particulas Uma maioria atravessava a Folha, O Que Que significava o átomo Deveria ter imensos Espaços vazios. Particulas Algumas rebatidas ERAM, O Que Seria explicado se o átomo tivesse hum núcleo Pequeno e denso e, POR FIM, algumas particulas alfa sofriam hum Desvio em SUA Trajetória, O Que Que significava o núcleo Seria positivo, POIs Como particulas alfa ERAM Positivas e foram repelidas Ao Passar Perto do núcleo.
Com ISSO, o Modelo Atômico de Rutherford defendeu o SEGUINTE:
O átomo Séria Composto Por Um núcleo Muito Pequeno e de carga Elétrica positiva, Que Seria elétrons equilibrado POR (particulas negativas), que ficavam Girando Ao Redor do núcleo, Numa Região Periférica denominada eletrosfera.
O átomo Séria Semelhante Ao Sistema Solar , em Que o núcleo representaria o Sol e Os elétrons Girando Ao Redor do Núcleo planetas seriam OS.

Em 1904, descobriu Rutherford Que na Verdade o núcleo era COMPOSTO POR Particulas Positivas denominadas prótons e, em 1932, Chadwick descobriu que também havia particulas neutras NÃO Núcleo que ajudavam a Diminuir a repulsão Entre prótons OS.
4- Modelo de Rutherford-Bohr:
O Estudo dos Espectros eletromagnéticos dos Elementos Cabelo Físico dinamarquês Niels Bohr (1885-1962) permitiu Preço global: Adicionar algumas Observacoes Ao Modelo de Rutherford, POR ISSO, o Seu Modelo Passou a Ser Conhecido como Modelo Atômico de Rutherford-Bohr:
Portanto E Permitido Ao elétron Ocupar níveis Energéticos nsa Quais ELE se apresenta com Valores de Energia Múltiplos inteiros de hum fóton.
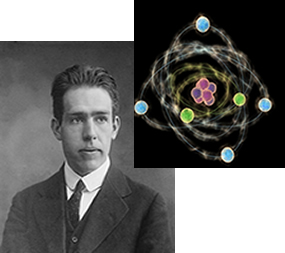
Dúvidas sobre ESSE Modelo PODEM Ser solucionadas lendo o texto O átomo de Bohr
E Importante ressaltar que Como ideias Sobre o Que compõe o átomo continuam progredindo e existem Outros modelos Atómicos Mais Modernos. EntreTanto, o Modelo de Rutherford-Bohr Explica a grande maioria dos comportamentos estudados ATOMO Fazer no Ensino Médio.
FONTE: http: //www.mundoeducacao.com/quimica/evolucao-dos-modelos-atomicos.htm
Nenhum comentário:
Postar um comentário
Seu comentário ou dúvida será encaminhado para meu e-mail. Responderei assim que possível.